植物转录调控检测试剂盒
-
植物转录调控检测试剂盒
Plant Transcriptional Regulation Assay Kit
产品内容:
产品组成 类型 规格 (1 Set) 储存温度
pGreenII 0800-LUC 空载质粒 10 μg -20℃
pGreenII 62-SK 空载质粒 10 μg -20℃
pGreenⅡ 0800-35S-5×GAL4–LUC 对照质粒 10 μg -20℃
pGreenⅡ 62-SK-BD-VP16 对照质粒 10 μg -20℃
pGreenII 0800-35S-LUC 阳性质粒 10 μg -20℃
运输及储存条件:蓝冰运输;-20℃储存,保质期 2 年。
产品介绍:
本试剂盒主要用于在植物系统中研究转录因子对下游靶基因的调控作用。采用双荧光素酶(Dual-luciferase,Dual-Luc)报告基因检测系统,在同一细胞内同时表达萤火虫荧光素酶(FLuc)和海肾荧光素酶(RLuc),两者分别可以催化荧光素和腔肠素发生氧化反应并产生荧光,通过化学发光检测仪可以检测到发光强度。RLuc 作为内参基因可以减少细胞活性和转染效率等外在因素产生的实验误差。
启动子能活化 RNA 聚合酶,使之与模板 DNA 准确地相结合并具有转录起始的特异性。转录因子(TFs)调节基因表达,保证目的基因以特定的强度在特定的时间与空间表达蛋白质分子。将启动子区域序列构建到报告基因载体pGreenII 0800-LUC 上,将目的蛋白 CDS 序列构建到 pGreenII 62-SK 载体上,然后共转植物细胞,最后通过分析双荧光素酶的表达水平,
反应转录因子对启动子的调控作用[1-5]。详细实验原理,可参考说明书后提供的参考文献。
图 1 试剂盒原理示意图

产品特点:
1. 本产品主要用于研究转录因子对下游靶基因的调控作用;也可用于启动子结构分析、启动 子活性分析、启动子 SNP 分析等实验中。
2. 本试剂盒提供了2个空载质粒,包含报告基因表达载体 pGreenII 0800-LUC、表达转录因子的载体 pGreenII 62-SK。
3. 提供的两个对照质粒,为经典的 BD-VP16 与 5×GAL4 UAS 结合并激活下游报告基因 FLUC的表达。本对照组合仅用于证明系统的可靠性与稳定性。
4. 提供的阳性质粒 pGreenII 0800-35S-LUC,便于分析检测试剂的可靠性。
5. 优化了经典实验体系。内参基因 RLUC 与报告基因 FLUC 整合于同一载体,内参控制更准确,操作更简便。
6. 本试剂盒提供了在植物中研究转录因子对下游靶基因调控作用的实验方案。检测系统灵敏高效,应用范围广。
注意事项:
1. 本产品提供了在植物系统中研究转录因子对下游靶基因调控作用的基本实验方案,方案不唯一,使用者应根据文献资料及自己课题的实际情况对实验方案进行调整。
2. 第一次使用本产品质粒时,请重新转化大肠杆菌克隆菌株(如 DH5α、TOP10)扩繁,提取质粒后使用。
3. 本产品仅供科研使用。请勿用于医药、临床诊断或治疗、食品及化妆品等用途。
实验方案:(在开始操作前请先阅读注意事项)
- 载体构建
(1)质粒基本信息
质粒名称
质粒大小
携带抗性
使用说明
pGreenII 0800-LUC
6382 bp
KanR
报告基因载体
pGreenⅡ 62-SK
3347 bp
KanR
转录因子表达载体
pGreenⅡ 0800-35S-5×GAL4-LUC
7407 bp
KanR
pGreenⅡ 62-SK-BD-VP16
4085 bp
KanR
正调控对照载体
pGreenII 0800-35S-LUC
6689 bp
KanR
阳性对照载体
(2)重组载体构建
将所研究的启动子序列(ProX)构建到 pGreenII 0800-LUC 载体的 MCS 区,得到 pGreenII 0800-ProX-Luc 质粒;将所研究的目标蛋白的 CDS 序列(Y)构建到 pGreenII 62-SK 载体的MCS 区,得到 pGreenⅡ 62-SK-Y 质粒。可用的酶切位点如图 2 所示(更多序列信息请查看载体图谱)。
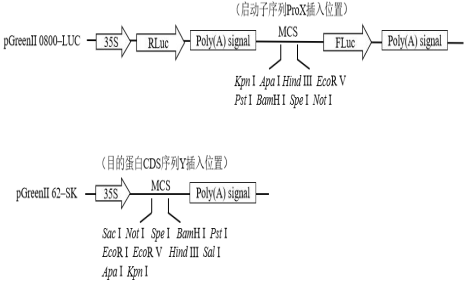
图2实验组载体构建示意图
注意:载体构建完成后,由于受体的不同,有两种方法可以进行检测,分别为原生质体检测法和烟草瞬时转化检测法。这两种方式各有优缺点,下面我们分别提供了这两种方法的基本操作流程,可根据需求选用,也可适当调整。
二、原生质体检测
(1)去内毒素质粒提取(建议采用去内毒素质粒进行原生质体转化)
将用户构建好的2个实验组质粒、2个正调控对照质粒(可选)、1个阳性对照质粒(可选)转化入大肠杆菌菌株DH5α得到单克隆菌落。
- 从平板上挑取含有相应质粒的大肠杆菌单菌落到1mLLB培养基中(含有50μg/mLKan),过夜培养。
2. 取 200 μL 上一步得到的菌液到 200 mL LB 培养基中(Kan),过夜培养至 OD600约1.0-1.7(12-14 h)。
3.采用去内毒素质粒大提试剂盒制备去内毒素质粒用于植物原生质体转化。详细制备过程参照试剂盒说明书。
(2)植物原生质体制备及转化
1.根据所研究的物种,在本公司选择合适的原生质体制备及转化试剂盒或者自行制备原生质
体及转化。本司已有烟草,玉米,番茄,小麦,水稻,拟南芥,柑橘,大豆,马铃薯,芸薹属、棉花、辣椒、甘蔗、高粱、橡胶草、白车轴草等多种原生质体制备及转化试剂盒,更多产品信息请查阅本司官网或咨询本司技术人员。
- 在转化过程中,将Reporter质粒与Effector质粒各取5-10μg(总体积不大于10μL)共转化制备好的植物原生质体,每个处理重复3-5次(一个处理同时转化3-5管原生质体)。详细制备及转化方法请参考相应试剂盒的说明书或其它资料。
可能的处理组合如表1,方案不唯一,可参考文献资料等调整。
表1原生质体转化组合
组别
处理组合
转化
对照组
pGreenII 0800-ProX-Luc+pGreenⅡ 62-SK
共转
实验组
pGreenII 0800-ProX-Luc+ pGreenⅡ 62-SK-Y
共转
正调控对照组(可选)
pGreenⅡ 0800-35S-5×GAL4-Luc+pGreenⅡ 62-SK-BD-VP16
共转
阳性对照组(可选)
pGreenII 0800-35S-Luc
单转
- 将转化完的原生质体转移至细胞培养板中,23℃孵育 16 h 后进行双荧光素酶活性检测。
(3)双荧光素酶活性检测
1. 将细胞培养板中的原生质体转移至 2 mL 离心管中,按照相应原生质体的离心速度及时间 离心收集培养 16 h 后的原生质体,弃掉培养液。
2. 采用双荧光素酶报告基因检测试剂盒,向收集好的原生质体中加入适量的裂解液,室温裂解5 min,12,000 rpm 离心 10 min,取一定体积的上清到酶标板中(白色不透明),加入底物后,利用酶标仪的化学发光检测功能,分别测定 FLUC 和 RLUC 的值,计算 FLUC/RLUC,即为相对荧光活性值(Relative luciferase activity)。详细实验方法请参考相应试剂盒的说明书或其它资料。
三、烟草瞬时转化检测法
(1)农杆菌转化
将用户构建好的 2 个实验组质粒、2 个正调控对照质粒(可选)、1 个阳性对照质粒(可选)分别转化农杆菌 GV3101(pSoup-p19)感受态,按照感受态说明书方法操作,涂布在含有 50 μg/mL Kan 的 LB 或 YEB 平板上。28℃培养 2-3 天至长出单菌落。
(2)侵染烟草
1. 摇菌:从上一步得到的平板上挑取直径约 1-2 mm 农杆菌单菌落到 5 mL 的 LB 液体培养基中(含有 50 μg/mL Kan 和5 μg/mL Tet),过夜培养14-18 h。使用分光光度计测定菌液的 OD600 值,OD600值不超过 1 即可(一般在 0.6-1.0 之间)。
注 1:实际操作时可根据后续试验组合需要,扩大或缩小摇菌体积。
注 2:在含有 Tet 的培养基中,农杆菌生长速度较慢,也可直接在含有 Kan 的培养基中摇菌。
2.配制 Activation Buffer:以配制10 mL为例,在无菌条件下,取农杆菌侵染液10 mL,加入10 μL(1/1000)体积的100 mM 乙酰丁香酮混匀备用。
注:Activation Buffer 需要现配现用。
3. 混菌,收集菌体:根据实验处理组合(图3),在无菌离心管中按照 1:1 体积混合两种菌液(阳性对照组为一种菌液)。4000 g 离心 10 min 收集菌体,弃去上清。
4. 重悬菌体:第 3 步收集到的菌体每管用一定体积的 Activation Buffer 重悬至 OD600不超过1,在 0.4-0.6 之间最佳,室温避光静置 3 h,期间可上下颠倒 2-3 次防止菌体沉淀到管底。
5. 注射法侵染烟草叶片
使用 1 mL 无菌注射器吸取上一步得到的重悬液;避开烟草叶脉,确认要注射的区域(如图 3所示),先用注射器针头在要注射的区域中间轻微划一下,造成“微创”,注意不要划破叶片;左手抵在叶片的正面,右手将注射器(不带针头)垂直压在烟草的背面,右手指慢慢推压注射器,观察转化液在表皮下扩散到一定范围(如图 3 圆圈所示区域,具体范围视烟草叶片大小而定,注射范围不必过大,有一小片区域即可满足试验需求,务必使各处理组在一片叶子上的扩散范围互不影响)。
每次试验建议将互为对照的组合尽量注射到同一片叶子上(图 3)。同一株烟草建议至少选取2-3 个叶片进行注射。同一批试验建议至少注射 3 株烟草。
图 3 注射法侵染烟草示意图

(3)结果观察
荧光素酶成像
1. 配制 1 mM 荧光素底物工作液:将 25 mg D-荧光素钾盐(分子量:318.41)用 8 mL 无菌水溶解配制成 0.01 M 的母液。用无菌水稀释 10 倍后为 1 mM 荧光素底物工作液。
注:配置好的荧光素钾盐母液可在-80℃避光保存 1 年,工作液可在-20℃避光保存 1 个月,建议分装后保存,避免反复冻融。
- 注射荧光素底物:选取注射菌液 36-48 h 后的烟草叶片,用 1 mL 无菌注射器吸取 1 mM 荧 光素底物工作液注射烟草叶片背面已经注射过菌液的所有区域。
注:由于蛋白在烟草叶片内表达受多种因素影响,底物最佳注射时间需通过预实验摸索确定。
3. 观察拍照:加入底物后,黑暗静置 10 min,剪取注射完底物的烟草叶片,将其背面朝上放入化学发光成像系统中检测发光情况并拍照,半小时内检测完毕。
注:使用植物活体成像系统观察活体荧光效果最好。也可尝试使用一般的具有化学发光观察功能的成像系统,可能对于一些不灵敏的互作反应取不到良好的观察效果。观察时可通过手动调节曝光时间等参数达到最佳的观察效果。
双荧光素酶活性检测
- 使用打孔器从上一步培养 2-3 天后的烟草叶片上取下烟草小圆片,每个侵染部位取 2-3 片, 加入到装有研磨用不锈钢珠的 2 mL 离心管中,立刻放入液氮中速冻,使用组织破碎仪将样品研磨成细粉。如果没有组织破碎仪,也可手动液氮研磨。
- 使用双荧光素酶报告基因检测试剂盒,向研磨好的样品中加入适量的裂解液,室温裂解 15 min,12,000 rpm 离心 10 min,取一定体积的上清到酶标板中(白色不透明),加入底物后,利用酶标仪的化学发光检测功能,分别测定 FLUC 和 RLUC 的值。计算 FLUC/RLUC,即为相对荧光活性值。详细实验方法请参考相应试剂盒的说明书或其它资料。
实验案例
采用植物转录活性调控检测试剂盒,在烟草原生质体中检测转录因子 BD-VP16 对下游靶基因的调控作用。结果如图 4 所示,BD-VP16 与 5×GAL4 UAS 实验组比对照组(62-SK 与5×GAL4 UAS)的相对荧光素酶活性显著升高,表明 BD-VP16 与 5×GAL4 UAS 互作并激活了下游 FLUC 基因的表达。

图4在烟草原生质体中的相对荧光素酶活性