马铃薯原生质体制备及转化试剂盒
-
马铃薯原生质体制备及转化试剂盒
货号:hyypc1161-5T 2798元
产品内容:
产品内容
规格
储存温度
A盒
酶解缓冲液 EC1(Buffer EC 1)
110 mL
-20℃
酶解缓冲液 EC2(Buffer EC 2)
8 mL
酶 E1(Enzyme 1)
1.8 g
酶 E3(Enzyme 3)
0.3g
B盒
培养液 CM(Buffer CM)
100 mL×6
4℃
分离液 MP(Buffer MP)
60 mL
重悬液 RS(Buffer RS)
15mL
转化液 TP(Buffer TP)
18mL
细胞筛
5个
运输及储存条件:
A 盒为蓝冰运输,B 盒为常温运输;收货后应将 A 盒避光保存于-20℃ , B 盒保存于2-8℃; 本试剂盒溶液 易污染,建议开封后立即使用;试剂盒组分未开封的有效期为 18 个月。
产品介绍:
本试剂盒主要通过酶的消化作用,酶解植物细胞壁获得原生质体。适用于从马铃薯叶片中分离和转化原生 质体。获得的原生质体可用于蛋白的亚细胞定位,验证蛋白间的相互作用,转录因子的转录调控等实验。
产品特点:
本试剂盒包含原生质体制备和转化需要的全部试剂,按照每次 20 mL 酶解液的使用量,可供 5 次原生质体 制备以及 120 个转化反应。
注意事项:
1. 分离制备的原生质体没有细胞壁的保护,非常脆弱,整个实验操作过程中动作尽可能轻柔。
2. 实验过程中尽可能使用切过尖的枪头,保证切口平滑,可减少原生质体破裂。
3. 若无水平转子,可适当调整离心力、离心时间、升降速,以保证实验成功。
4. 转化时建议添加空载荧光对照(例如 pBI221-EGFP), 以验证操作步骤无问题。
5. 本试剂盒经过多次质检,可确保实验的稳定性。若实验员为首次实验,建议进行预实验以熟练操作流程。 在每步后进行镜检,观察原生质体状态, 以自检实验操作流程。
6. 请使用去内毒素质粒进行转化。
操作步骤:(在开始操作前请先阅读注意事项)
一、准备工作
1. 需要自行准备的材料
锋利刀片;血球计数板;50 mL 圆底离心管;2 mL 离心管,切过尖的灭菌蓝枪头和黄枪头,10 µL 白枪头。
2.酶解液配制
配制顺序
组分
20 mL 体积
第一步
酶解缓冲液 EC1(Buffer EC 1),
使用前可 55℃水浴融化,冷却至室温使用
酶 E1(Enzyme 1)
酶 E3(Enzyme 3)
19 mL
0.3 g
0.02 g
第二步
混匀后 55 ℃水浴 10 min ,期间颠倒混匀 2-3 次。
随后于室温静置,待其冷却至室温后,加入以下成分。
第三步
第四步
第五步
酶解缓冲液 EC2(Buffer EC 2)
使用酶解缓冲液 EC1(Buffer EC 1)定容
过滤除菌(可选步骤)
200 µL
注:
- 酶解液必须现配现用,根据实验的需要选择酶解液是否需要过滤除菌。
二、原生质体的分离制备
1. 准备马铃薯材料,取材以 30 d 内的幼嫩真叶为优。
2. 取 5-10 片(约 1 g)叶片,用锋利刀片平行主叶脉,切成 0.5-1.0 mm 的细条。
3. 将切好的细条放入装有 20 mL 酶解液的50 mL 容积的小烧杯中,锡箔纸包裹。
注:避光步骤可防止原生质体的光合作用,有氧呼吸释放的活性氧可能不利于原生质体生存。
4. 避光 28 ℃ , 45 rpm/min 摇床上孵育 4 h。
5. 用 1 mL 培养液 CM 润洗细胞筛。
6. 将酶解后的产物用细胞筛过滤,用镊子或无菌枪头尾部轻轻挤压酶解物帮助其充分释放原生质体,此时 肉眼可见浓绿色液体滴落(挤压步骤十分重要)。用 5 mL 培养液 CM 冲洗酶解器皿和未消化的叶片 2 次
(使用切过尖的蓝枪头冲洗),将所有液体收集至 50 mL 圆底离心管中。
注:操作过程尽可能轻柔,避免剧烈震荡,过滤时可以将 50 mL 离心管倾斜 70 ° , 缓冲溶液下落时产生的 碰撞力,防止原生质体破碎。
7. 用切尖枪头,取一滴酶解液进行镜检。若在 100×视野中可观察到圆形的原生质体,则可继续进行实验。 若视野内原生质体大量破碎或皱缩发黑,则弃去。
8. 选用水平转子,室温 800 rpm 离心 5 min ,升速 3 ,降速 3 ,去上清(管中绿色沉淀即为原生质体)。
注:离心时,可调低离心机的升速和降速。升速过快,原生质体可能离到管壁上导致破碎;降速过快,可 能导致管底原生质体悬起。
9. 向上述沉淀中加入 5 mL 培养液 CM 温柔重悬位于底部原生质体(切过尖的蓝枪头),备用。
10. 将 10 mL 分离液 MP 加入新的 50 mL 圆底离心管后,将第 9 步液体缓慢的放在分离液 MP 上。此时可 观察到上层为绿色原生质体,下层为无色分离液 MP。
11. 将上述液体室温 800 rpm 离心 5 min,升速 3 ,降速 3。缓慢拿取并吸取位于中间环带的原生质体,约 3 mL 于新的 50 mL 圆底离心管中。
12. 向上述液体中加入 5 mL 培养液 CM ,室温 800 rpm 离心 5 min ,升速 3 ,降速 3 ,去除上清。
注:在离心前,可以显微镜下观察原生质体的状态和血球计数板计数。
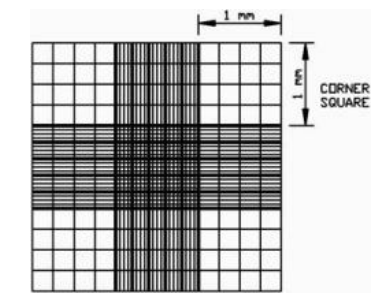
血球计数板的使用:
如下图所示,在血球计数板上盖玻片,分别从两侧凹槽加入样品。使用中央区域长和宽都是 1 mm 的方形 区域进行计数(25 个中方格)。分别统计正方形四个顶角和中央的小正方形的细胞数量,取平均值再乘以 25(正方形被分成了25 个小正方形),计算该区域的细胞数量,该区域的体积为 0. 1 µL(长 1 mm,宽 1 mm, 高 0. 1 mm )。计算获得的细胞数量,原生质体浓度(个/mL)=25 个中方格原生质体数×104 ×稀释倍数。

- 在上述沉淀中加入 1 mL 培养液 CM ,用切尖蓝枪头转移至 2 mL 圆底离心管中。800 rpm 离心 3 min, 升速 3 ,降速 3 ,去上清,用相应体积的重悬液 RS 重悬原生质体,调整原生质体密度为2×105/mL 。(根 据细胞数量和所需反应数,加入对应的重悬液 RS 体积,100 µL/1 个反应)
三、原生质体的转化
1. 在 2 mL 灭菌圆底离心管中加入 5-20 µg(总体积不超过 10 µL)纯化后的高质量质粒(去内毒素),随 后加入 100 µL 上述重悬后的原生质体,轻弹混匀,42℃水浴 5 min。
2. 向上述溶液加入 110 µL 的转化液 TP ,颠倒混匀,室温避光孵育 15 min 。请注意严格控制孵育时间。
注:去内毒素质粒对转化效率有极明显提升(近 3 倍) ,建议购买 PE036 去内毒素质粒大提试剂盒(吸 附柱法)。原生质体与转化液 TP 较难混匀,请耐心缓慢操作,以至充分混匀,保证转化效率。
3. 加入 1 mL 培养液 CM ,轻柔颠倒混匀,终止转化。室温 800 rpm 离心 3 min ,升速 3 ,降速 3 ,在不损 失原生质体的情况下,尽可能去上清。
4. 加入 1 mL 培养液 CM 重悬原生质体,室温 800 rpm 离心 3 min ,升速降速 3 ,去上清。
四、原生质体的培养和收集
1. 加入 1 mL 培养液 CM 培养悬浮细胞,此时可取样镜检,观察原生质体状态。随后将离心管于室温水平 避光放置,孵育 12-16 h。
2. 收集细胞时,缓慢拿起离心管,用切尖枪头将附着在管壁上的细胞轻轻悬起,室温 800 rpm 离心 3 min, 升速 3 ,降速 3 ,去除大部分培养液 CM ,收集原生质体,用于后续实验。
可选:用 1 mL 酶解缓冲液 EC2 润洗细胞培养板后,将 1 mL 培养液 CM 加入细胞培养板备用。将 1 mL 培养液 CM 重悬原生质体,将其加入上述细胞培养板中,室温过夜培养。